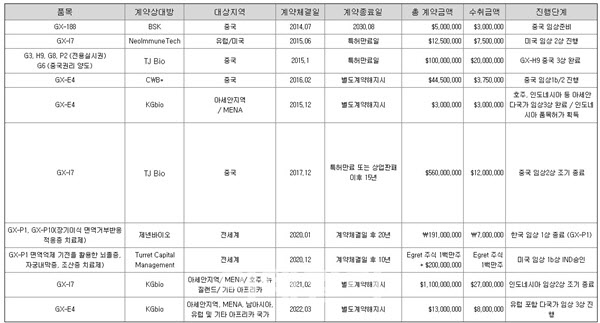
지난해 제넥신 3분기 보고서를 살펴보면 기술이전 계약은 국내외 7개 기업과 10건을 체결했다. 이 중 네오이뮨텍(미국), 일코젠(튀르키예), KG바이오(인도네시아), TJ바이오(구 아이맵/중국), 제넨바이오(한국)는 제넥신 합작사거나 관계사다. 이들과 맺은 기술이전 계약은 총 6건에 달한다. 기술이전 규모를 떠나 실효성에 의문부호가 지워지지 않는 이유다.
반면 제넥신 합작사나 관계사가 아닌 기업과의 기술이전은 △중국 BioSciKin과 GX-188E 계약 △중국 상하이 ChemoWanbang Biopharma와 GX-E4 계약 △터렛 캐피털과 GX-P1 계약 총 4건이다. 문제는 제넥신 기술이전 계약 중 일부 계약는 사실상 빈껍데기뿐이거나 파트너사의 불가피한 상황으로 임상 개발 및 계약 내용 달성이 어렵다는 점이다.
|
1900억원 계약, 사실상 폐기 수순
제넥신은 2020년 제넨바이오에 ‘PD-L1’과 변형(modified) IL-10이 융합된 차세대 이중융합 면역억제제 ‘GX-P10’과 PD-L1 단일융합 면역억제제인 GX-P1을 총 1910억원 규모로 기술이전했다. 2018년부터 제넨바이오와 연을 맺었던 제넥신은 2020년 2월까지 수차례 지분 투자를 단행해 13.06%로 최대주주 지위에도 올랐다.
최대주주에 오르면서 기술이전 가치가 퇴색됐지만 회사 측은 큰 기대를 걸었다. 제넨바이오는 국내 이종장기 산업을 선도하는 기업으로 제넥신 파이프라인을 도입해 장기이식 면역거부반응 치료제를 개발할 예정이었다. 제넥신은 계약금 70억원을 수취했다. 이후 임상 3상 최종 마무리시 100억원, 상용화시에는 누적 순매출액 1000억원 달성시 40억원, 누적 순매출액 2500억원 달성시 100억원, 누적 순매출액 5000억원 달성시 200억원, 누적 순매출액 1조원 달성시 400억원, 누적 순매출액 2조원 달성시 1000억원의 마일스톤을 받게 되는 계약이다.
2022년 94억원이던 매출은 2023년 53억원으로 감소했고, 지난해에는 3분기까지 누적 매출이 2135만원에 불과했다. 특히 제넨바이오를 이끌어왔던 김성주 대표와 핵심 연구진들이 퇴사해 연구개발이 중단된 상태다. 제넥신도 제넨바이오 지분을 2021년부터 매도하면서 최대주주에서 내려왔고, 지난해 3분기 보고서 기준 제넨바이오 지분은 없는 상태로 확인된다. 제넨바이오 내부 상황에 정통한 업계 관계자는 “제넨바이오 핵심이던 김성주 대표가 사임하면서 제넨바이오의 핵심 기능은 멈춰진 상태”라며 “이종장기나 치료제 개발이 아닌 회사 존폐가 위협받고 있다. 기술이전 계약도 더 이상 진행되기 어려울 것”이라고 전했다.
中 기술이전 계약도 오리무중...파트너사 홈페이지도 없어
제넥신은 2014년 7월 중국 바이오스씨킨(BioSciKin)과 자궁경부암 치료백신 GX-188E를 중국내 지역에 기술이전하는 계약을 체결했다. 500만 달러 규모로 임상 개발에 따른 마일스톤과 상용화 6개월 전 로열티 계약을 맺는 내용이 포함된 계약이었다.
제넥신은 2022년 국내에서 자궁경부암 임상 2상을 완료했지만 이후 진척이 없는 상태다. 제넥신 관계자는 “자궁경부암 임상 2상에서 좋은 결과가 나왔지만, 기존 자궁경부암에 2차 치료제로 쓰이던 제품이 1차 치료제로 올라오면서 시장성이 축소됐다고 판단해 중단했다”면서도 “중국 바이오스씨킨과 맺은 기술이전 계약은 여전히 진행되고 있다”고 말했다.
제넥신 측은 “바이오스씨킨은 운영되고 있는 것으로 알고 있다”면서도 “우리도 회사 홈페이지를 찾아봤지만 찾지 못했고 없는 것으로 파악하고 있다”고 전했다. 이에 업계 일각에서는 “정상적으로 운영 중인 기업 홈페이지가 작동하지 않거나 없는 경우는 중국이라도 흔히 보기 어렵다. 회사 측간 소통도 원할하게 되지 않는 것처럼 느껴진다”면서 “임상 개발 현황 등을 종합했을 때 중국 측과의 기술이전 계약은 향후 수익 확보 측면에서 큰 의미가 없어진 것으로 판단된다”는고 꼬집었다.
플랫폼 기술-파이프라인 퀄리티가 문제?
업계에서는 기술이전 계약보다 제넥신 플랫폼 기술이나 파이프라인 자체에 약점이 있을 수 있다고 보고 있다. 제넥신은 지속형 항체융합단백질을 제조할 수 있는 hybrid FC 플랫폼 기술을 보유하고 있다. 이를 활용해 지속형 바이오베터(개량신약) 제품을 개발하고 있다.
바이오베터 임상 단계별 성공률을 보면 임상 1상이 84%로 바이오 신약(53%)보다 월등하고, 임상 2상의 경우 성공률이 74%로 동일하다. 임상 3상의 경우 성공률이 80%로 바이오 신약(53%)을 크게 앞선다. 전임상까지 포함했을 경우 전체 임상 성공률은 바이오 신약이 27%인데 반해 바이오베터는 41%다. 상업화까지 바이오베터 역시 쉽지는 않지만, 신약보다는 가능성이 높다.
다만 제넥신의 경우 큰 기대를 모았던 GX-188E는 핵심 제품이 되지 못했다. 베스트인 클라스를 목표로 했던 GX-E4는 국내에서 품목허가를 신청했지만, 식약처로부터 보완 요청을 받은 상태다. 제넥신 관계자는 “GX-E4는 식약처에서 요청한 보완 서류를 제출하기 위해 품목허가 재신청을 했다”며 “보완 서류는 준비하고 있지만, 제출 시기는 미정”이라고 말했다.






![[포토]공공기관 채용정보박람회 개최…“신규채용 2만4000명 추진”](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400899t.jpg)
![[포토] 설 명절 자금 방출](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400672t.jpg)
![[포토] 우체국쇼핑 "설 선물 특가로 구매하세요~"](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011400640t.jpg)
![[포토]윤석열 대통령 관저 출입하는 차량들](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300878t.jpg)
![[포토]'발언하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300770t.jpg)
![[포토] 이동활 한우자조금위원장, "올 설에 한우드세요~"](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300684t.jpg)
![[포토]'유튜브 생중계 화면 바라보는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300614t.jpg)
![[포토]국민의힘 비상대책위원회의](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011300576t.jpg)
![[포토] 추위 잊은 송어얼음낚시](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011200345t.jpg)
![[포토]윤석열 대통령 체포영장 2차 집행 초읽기](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011200302t.jpg)

![[포토]박현경,백여 명의 팬들과 즐거운 출정식 개최](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25011200149h.jpg)


