|
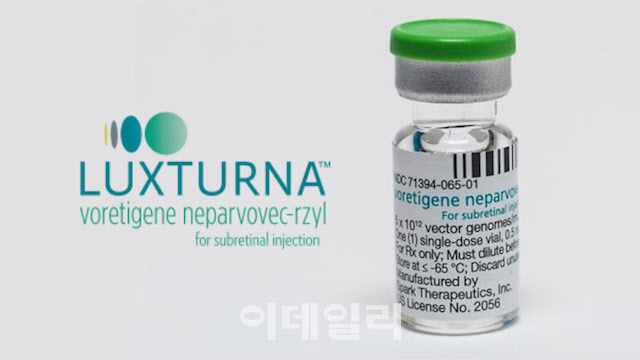
미국 스파크 테라퓨틱스(스파크)가 개발한 ‘2형 레버 선천성 흑암시’(LCA2) 치료제 ‘럭스터나’(보레티진 네파보벡)가 기대와 달리 지난 3월 국내에서 급여 문턱을 넘지 못했다. 한국노바티스는 지난 4월 보험급여 재도전에 나선 것으로 알려졌다.
럭스터나의 적응증인 LCA2는 RPE65 유전자 돌연변이로 인해 망막세포가 파괴될 때 발생하는 것으로 알려졌다. 스파크는 정상 RPE65 유전자를 단회 투여 방식의 망막하에 주사하는 방식으로 럭스터나를 개발했다.
지난 2017년 12월 미국 식품의약국(FDA)가 LCA2 대상 최초 치료제로 럭스터나를 승인했다. 이듬해인 2018년 11월 유럽의약품청(EMA)도 같은 적응증으로 럭스터나를 승인했고, 헬스캐나다나 식품의약품안전처(식약처)도 각각 2020년과 2021년에 차례로 해당 약물을 시판허가한 바 있다.
럭스터나의 진출 시장이 늘어가는 사이 약물의 판권은 글로벌 제약사(빅파마)들에게로 넘어갔다. 지난 2018년 1월 노바티스가 스파크로부터 럭스터나의 미국 외 글로벌 상업화 권리를 총 1억8000만 달러 규모로 기술도입했다. 2019년 스위스 로슈가 스파크를 43억 달러 규모로 인수했다.
한편 럭스터나의 경쟁 유전자치료제의 임상 개발도 속속 진행되고 있다. 미국 유전자교정 전문 기업 에디타스 메디신(에디타스)이 LCA10 대상 유전자 치료 신약 후보물질 ‘EDIT-101’의 임상 1/2상을 진행중이다. 럭스터나의 적응증인 LCA2보다 시장성이 큰 LCA10 대상 약물이 개발되고 있는 것이다.
하지만 업계에서는 EDIT-101의 승인 가능성에 대한 반응이 엇갈리고 있다. 한 업계 관계자는 “스파크가 환자 규모 면에서 더 시장성이 큰 LCA10이 아닌 LCA2를 개발한 것은 기술적인 문제였다”며 “LCA2의 유전자가 작아 현재 널리 쓰는 전달체인 아데노연관바이러스(AAV) 실어 보내기 좋다. 반면 LCA10 유전자는 크기가 커서 에디타스의 약물이 실제 치료효과를 발휘할지 임상 결과를 지켜봐야 한다”고 말했다.






![[포토]교육부-보건복지부 장관, 의료개혁 관련 브리핑](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011000886t.jpg)
![[포토]제주항공 참사 합동분향소 10일 운영 종료](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011000832t.jpg)
![[포토]박종준 처장, 특수공무집행방해 혐의로 경찰 출석](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25011000511t.jpg)
![[포토] 맘스홀릭베이비페어 전시](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010901108t.jpg)
![[포토]수도권 첫 한파주의보](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010901027t.jpg)
![[포토]'무죄'받고 이동하는 박정훈 전 수사단장](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900998t.jpg)
![[포토]기자회견 하는 김상욱 의원](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900987t.jpg)
![[포토]전국정당을 넘어 K-정당으로 향하는 더불어민주당](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900948t.jpg)
![[포토]발언하는 권영세 위원장](https://image.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010900599t.jpg)
![[포토]포즈 취하는 팀테일러메이드](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2025/01/PS25010800134t.jpg)
![[포토]홍재경 아나운서,론칭쇼 진행합니다](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25010800229h.jpg)
![캠핑 떠나는 전현무…든든하게 곁 지키는 'NEW 무카' 정체는[누구차]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/01/PS25011100176h.jpg)


