|
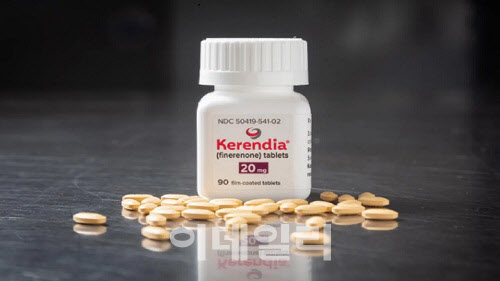
미국 식품의약국(FDA)이 2021년 7월에 승인한 독일 바이엘의 당뇨병성 신부전 치료제 ‘케렌디아’(성분명 피네레논)를 승인했다. 케렌디아는 무기질 코르티코이드 수용체의 비스테로이드성 선택적 길항제로 해당 기전을 가진 최초의 약물이다.
케렌디아가 출시 가능한 국가를 빠르게 확대되고 있어, 올해 역시 매출이 큰폭으로 상승할 것이란 전망이 나온다. 바이엘은 지난해 유럽 연합(EU, 2월)과 일본(3월), 한국(5월), 인도(8월), 캐나다(10월) 등 각국 의약 당국으로부터 같은 적응증으로 케렌디아를 차례로 허가받았다.
바이엘은 지난 1월 JP모건 헬스케어 컨퍼런스에서 올해 케렌디아가 30억 유로(한화 약 4조 1600억원) 이상의 매출을 올릴 것이라는 전망을 내놓은 바 있다.
미국 임상 내분비학회(AACE)가 지난해 10월 ‘포괄적 당뇨병 관리 지침’을 개정해, 케렌디아를 2형 당뇨병성 만성 신장병 환자 대상 A급 치료제로 권고한다고 밝혔다. 사실상 해당 질환에서 쓸 수 있는 최고의 표준요법제로 인정한 것이다.
바이엘는 경쟁 제제인 ‘포도당나트륨공동수용체(SGLT)-2’ 억제제와 케렌이아의 병용요법도 연구하는 중이다. 참고로 대표적인 SGLT-2 제제 중 당뇨병성 합병증 적응증을 획득한 약물은 독일 베링거 인겔하임의 ‘자디앙’(성분염 엠파글로플로진)과 영국 아스트라제네카의 ‘포시가’(성분명 다파글로플로진) 등이 있다. 바이엘 측이 케렌디아와 병용한 SGLT-2 제제를 구체적으로 명시하진 않지만, 새로운 매출 시너지를 만들어갈 연구에 박차를 가하고 있는 것으로 알려졌다.
한편 지난 1월 미국 의약전문매체 ‘파마씨우티컬 테크놀로지’는 2038년 케렌이아의 매출이 111억 달러에 이를 것이라는 전망을 내놓기도 했다. 기존 약물로 관리하기 어려운 당뇨병성 합병증 환자의 미충족 수요를 충족시켜줄 새로운 옵션이란 점에서 케렌디아에 대한 기대가 커지고 있다.








![[포토]김장나눔 펼치는 함영주 회장과 하나금융그룹 임직원들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100765t.jpg)
![[포토]'발언하는 손경식 회장'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100640t.jpg)
![[포토]최고위, '모두발언하는 박찬대 원내대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100624t.jpg)
![[포토]마다솜,통산 4승 만들어준 넘버원 볼](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100280t.jpg)
![[포토]여·야·의·정 협의체 1차 회의, '모두발언하는 한동훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100253t.jpg)
![[포토] 소방 "포스코 포항제철소서 큰 불 신고"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000360t.jpg)
![[포토] 이대한 '2024시즌 대미를 장식하며 동료들과 함께'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000314t.jpg)
![[포토]의협 대의원총회 참석하는 임현택 회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000295t.jpg)
![[포토]잠시 쉬어가는 서울야외도서관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000281t.jpg)
![[포토]‘코리아세일페스타’ 개막…숙박·놀이공원·학습지 등 신규 참여](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000259t.jpg)

![[포토]마다솜,저의 볼 마크입니다](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111100281h.jpg)


