|
식약처는 이날 보도참고자료를 통해 “해당 의약품이 치료제로서 효능이 입증되고 기대 효과가 안전성을 상회한다고 판단되면 특례 수입 등을 통해 코로나19 환자에게 사용될 수 있도록 적극적으로 조치할 계획”이라고 설명했다.
다만 식약처는 아직 코로나19 치료제로 렘데시비르의 안전성과 유효성을 판단할 단계는 아니라고 선을 그었다. 식약처는 “해당 의약품은 현재 임상시험이 진행되고 있다”며 “국내외 임상시험 진행 상황을 예의주시하고 있다”고 언급했다.
현재 국내에서도 렘데시비르 임상 시험이 3건 진행되고 있다. 길리어드가 주도해 국립중앙의료원, 서울의료원, 경북대병원에서 진행 중인 임상시험과 미국 국립보건연구원(NIH)과 서울대병원이 협력하고 있는 임상시험도 있다.
식약처는 “렘데시비르의 유효성 판단을 위해서는 각 군당 분석 대상자 수, 시험대상자 정보(증상발현 정도 등) 등이 함께 검토돼야 한다”며 “안전성 판단을 위해서는 이상반응, 중도 탈락율 등 평가에 필요한 정보가 확인돼야 한다”고 말했다.
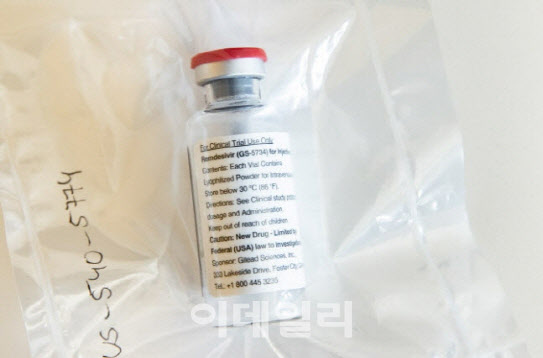
앞서 미국 현지시간으로 29일 NIAID는 렘데시비르가 초기 임상시험에서 코로나19로 입원한 환자의 회복 기간을 31% 줄였다고 밝혔다. 미국 식품의약국(FDA)은 렘데시비르에 대한 긴급사용승인을 검토할 것으로 알려졌다.
렘데시비르는 길리어드가 에볼라 치료제로 개발하려다 임상 2상에서 실패한 의약품이다. 길리어드는 약물재창출(리포지셔닝)방법으로 코로나19 치료제로 개발중이다.









![[포토] 이재경 '핀하이로 쏜다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100400197t.jpg)
![[포토] 축시 낭독](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100400720t.jpg)
![[포토] 2024 세계한인회장대회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100400598t.jpg)
![[포토]유현조,나이스 마무리 퍼트](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100400048t.jpg)
![[포토]박도은,핀 공략을 생각한다](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300270t.jpg)
![[포토]"예쁜 피부는 역시" 엘렌실라, W페스타 부스 운영](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300485t.jpg)
![[포토]전국 의대 교수, '의평원 무력화 막을 것'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300350t.jpg)
![[포토]부천국제만화축제 참가한 부천대학교 학생들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300332t.jpg)
![[포토]파란하늘과 가을 꽃](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300310t.jpg)
![[포토]개천절 경축식 만세삼창](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100300275t.jpg)

![[포토]임희정,최종일 우승 향한 미소](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24100700308t.jpg)


