뉴스 검색결과 9,286건
- 국산 코로나19 치료제, 내년 1월 1~2개 기대
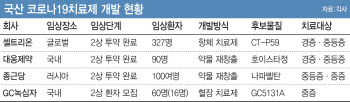
- [이데일리 노희준 기자] 국산 코로나19 치료제가 순조롭게 개발된다면 내년 1월께는 1~2개가 나올 것으로 기대된다. 셀트리온(068270)과 대웅제약(069620), 종근당(185750), GC녹십자(006280)가 연말 안에 조건부 허가를 위한 임상2상 결과 확보를 목표로 하고 있다. 백신 개발에선 늦었지만 1월께는 국산 치료제로 ‘빼앗긴 일상’에 숨통이 트일지 주목된다.[그래픽=이데일리 이미나 기자]◇ 셀트리온, 창립 19년만에 첫 신약 내놓나3일 제약 바이오업계에 따르면, 셀트리온은 이달 안에 식품의약품안전처에 코로나19 항체치료제(CT-P59)의 조건부 허가를 신청할 계획이다. 셀트리온 관계자는 “날짜를 특정하기 조심스럽다”면서도 “연말까지 신청을 목표로 하고 있다”고 말했다. 식약처는 코로나19 치료제·백신 개발을 앞당기기 위해 ‘고강도 신속 제품화 촉진 프로그램’을 운영중이다. 식약처 관계자는 “달력 기준(공휴일 포함 의미)으로 180일 소요되던 심사기간을 빠르면 40일까지로 단축해서 신속하게 심사할 예정”이라고 말했다.12월 넷째 주인 21일부터 40일째는 내년 1월29일이다. 12월 마지막주 28일부터 40일째는 2월2일이다. 따라서 셀트리온의 임상2상 결과 도출과 연내 조건부 허가 신청, 식약처 심사가 모두 순조롭게 진행되면 셀트리온 코로나19 치료제는 내년 1월말이나 2월 초 이전에 허가가 예상된다. 제약업계는 사안의 중요성, 국내 백신 개발의 뒤처짐 등을 감안할 때 정부가 40일의 심사 기간을 더 단축할 것으로 보고 있다. 셀트리온은 지난달 25일 코로나19 항체 치료제의 글로벌 2상 임상시험 환자 327명에 대한 투약을 완료했다. 현재 2상 결과를 도출 중이다.조건부 허가는 생명을 위협하거나 심각한 질병에 치료효과를 기대할 수 있는 의약품 등의 경우에 허가에 필요한 자료 일부(3상)를 시판 후 제출하도록 하는 조건에서 허가를 먼저 내주는 제도다. 때문에 3상 결과를 제출하지 못하거나 3상 결과가 좋지 않으면 허가가 취소될 수 있다. 조건부 허가라도 원래 개발 계획상의 처방 대상에 따른 제한 외에 의약품 처방에 다른 조건이 붙진 않는다. 일각에서 국내 조건부 허가 신청을 ‘긴급사용승인을 신청한다’고 표현하지만 잘못된 표현이다. 식약처 관계자는 “국내에서 긴급사용승인이라는 표현은 의료기기 체외진단시약(진단키트)에만 사용하고 있다”고 말했다. ◇ 대웅제약, 녹십자, 종근당 불꽃 경쟁…1월 치료제 개발 성패 갈려셀트리온의 강력한 경쟁자는 대웅제약, GC녹십자, 종근당 등이다. 대웅제약은 2상 환자 모집(90명)을 국내에서 가장 빠르게 마쳤다. 대웅제약 코로나19 치료제(호이스타정)는 경구용 치료제라 복용 편의성이 클 전망이다. 대웅제약 관계자는 “연내 임상 결과가 확보될 것으로 예상돼 내년 1월 (조건부)승인을 목표로 하고 있다”고 말했다.GC녹십자는 혈장 치료제(GC5131A)로 임상 2상을 진행중이다. 정부는 원래 올해 안에 혈장 치료제 허가를 목표로 했지만, 환자 모집에 시간이 걸리는 모양새다. 환자 60명 모집에 현재 16명(지난 23일 기준)을 등록했다. 러시아에서 코로나19 치료제(나파벨탄)를 개발 중인 종근당은 최근 임상 2상 중간평가 결과 임상적인 유용성을 확인했다. 종근당 관계자는 “100여명의 전체 피험자 등록과 투약을 마쳤다”며 “내년 1월 조건부 허가 신청을 목표로 식약처와 협의 중”이라고 했다.이밖에 부광약품(003000), 엔지켐생명과학(183490), 신풍제약(019170), 크리스탈지노믹스(083790), 동화약품(000020)도 코로나19 치료제 임상 2상을 진행 중이다. 제넥신(095700)과 뉴젠테라퓨틱스는 임상 1상에 진입했다. 해외 코로나19 항체 치료제(리제네론, 릴리, GSK, 아스트라제네카)가 국내에 ‘특례 수입’ 등의 형식으로 들어올 가능성이 없진 않다. 특례 수입에는 질병관리청장의 신청과 식약처 승인이 필요하지만 아직 식약처에 신청된 게 없다. 산업적 측면에선 내년 1월이 지나면 코로나19 치료제 개발 경쟁의 성패가 어느정도 갈릴 전망이다. 조건부 허가를 받은 곳과 환자 모집조차 하지 못한 곳 사이에 격차가 뚜렷해질 전망이다. 치료 대상에 따라 경쟁 구도도 갈린다. 셀트리온과 대웅제약은 모두 경증(mild) 및 중등증(moderate) 코로나19 환자 대상, 종근당은 중등증 및 중증(severe) 환자, GC녹십자는 중증 환자 대상이다. 셀트리온은 코로나19 치료제 개발에 성공하면 바이오의약품 위탁생산(CMO)과 바이오시밀러로 비상한 지 19년 만에 ‘신약 기업’으로 발돋움한다.