뉴스 검색결과 9,285건

- K바이오 '주무대' 자가면역질환 시장…한올바이오파마, 신약으로 합류하나
- [이데일리 노희준 기자] 셀트리온(068270), 삼성바이오에피스 등 국내 제약 바이오기업의 ‘주무대’인 자가면역질환 치료제 시장에 한올바이오파마(009420)가 신약을 앞세워 등장할지 주목된다. 한올바이오파마의 후보물질은 치료 대상과 기전이 두 회사와 달라 신약 허가시 국내 제약바이오 기업의 전체 자가면역질환 치료제 시장 파이가 커질 전망이다.31일 제약 바이오업계에 따르면, 한올바이오파마의 자가면역질환 치료제 후보물질(HL161)을 이전해간 글로벌 파트너사 ‘이뮤노반트’는 최근 중증근무력증을 대상으로 한 긍정적인 임상 2상 톱라인(임상 주요 지표)결과를 내놨다. 중증근무력증이란 면역계 이상으로 자기자신을 공격하는 병원성 ‘자가항체’가 근육세포를 공격해 근육수축 장애를 초래하는 자가면역질환의 하나다. 이뮤노반트는 올해 미국 식품의약국과(FDA)와 임상3상 시험 디자인을 검토해 내년에는 3상에 나설 계획이다. 앞서 한올바이오파마는 지난 2017년 12월에 로이반트사이언스에 이 물질을 5억달러(6000억원) 규모로 수출했다. 로이반트는 1년 뒤 이 후보물질만을 전담할 자회사 이뮤노반트를 설립해 개발을 맡겼다.한올바이오파마의 HL161은 자가면역질환에서 상대적으로 희귀질환을 노린다. 중증근무력증이나 갑상선 안병증, 온난항체 용혈성빈혈, 혈소판감소증 등이 그것이다. 갑상선 안병증이란 갑상선 호르몬이 과다 분비돼 시력저하나 실명, 안구도출 등이 나타나는 안구질환이다.이런 자가면역질환 시장은 치료제가 아직 없다. 스테로이드 등의 면역억제제나 혈장의 자가항체를 물리적으로 줄여주는 혈장분리교환술 등이 사용되고 있지만 부작용과 비용 문제로 제한적으로 이용되고 있을 뿐이다. 셀트리온의 바이오시밀러 램시마와 삼성바이오에피스의 바이오시밀러 임랄디, 베네팔리, 플릭사비 등이 노리는 관절염, 염증성 장질환, 궤양성 대장염 등의 자가면역질환 시장에 애브비의 휴미라, 얀센의 레미케이드, 화이자의 엔브렐 등 다국적 제약사의 블록버스터 신약이 즐비한 것과 다르다. 한올바이오파마의 HL161은 또 작용기전이 다르다. 자신을 공격하는 병원성 자가항체의 세포내 농도를 떨어뜨려 증세를 완화(Anti-FcRn)하는 방식을 작용 기전으로 한다. 반면 셀트리온의 램시마와 삼성바이오에피스의 자가면역질환 3총사는 몸에 염증반응을 일으키는 ‘종양괴사인자-알파(TNF-α)’를 억제하는 기전을 갖고 있다. 한올바이오파마의 HL161은 개발에 성공하면 전세계적으로 600억달러(70조)의 FcRn 억제제 시장에서 신약 대접을 받을 수 있다. 반면 신약이기 때문에 ‘복잡한 복제약’인 바이오시밀러보다 개발 위험이 크다. 특히 현재 한올바이오파마와 같은 기전을 사용해 약을 만들고 있는 경쟁사 알제넥스(Argenx)가 지난 5월 긍정적인 임상 3상 결과를 내놔 앞서있다.한올바이오파마는 같은 기전이라도 물질마다 효과가 다른 데다 특히 복용 편의성면에서 알제넥스 등 경쟁사와 차별화를 꾀할 수 있다는 입장이다. 알제넥스와 또다른 경쟁사 모멘타의 후보물질은 모두 병원에서 침대에 누워 혈관에 오랜 시간 맞아야 하는 정맥주사(IV)형이다. 반면 한올바이오파마 물질은 집에서 복부, 허벅지 등에 손쉽게 스스로 투약할 수 있는 피하주사(IV)형이다. 또한 한올바이오파마는 알제넥스가 하지 않는 갑상선 안병증 등 적응증(치료 대상)을 달리해 시장 공략에 나설 계획이다. 업계 관계자는 “한올바이오파마의 자가면역질환 치료제가 나오면 기존과 다른 희귀질환 쪽의 자가면역질환 시장이 열리게 되는 것”이라며 “기존 바이오시밀러 양대 산맥과 다른 기전과 다른 치료 대상을 공략하게 돼 전체 자가면역질환 시장에서 국내 경쟁력이 높아지는 계기가 될 것”이라고 말했다.
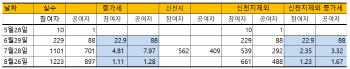
- 신천지 추가 SOS "이유 있었네"...녹십자 혈장치료제 혈장 공여 '둔화'
- 자료=GC녹십자, 5월 14일 혈장 공여 개시.[이데일리 노희준 기자] GC녹십자(006280)의 코로나19 혈장 치료제 개발에 관건인 완치자 혈장 확보 속도가 둔화된 것으로 나타났다. 혈장 치료제는 코로나19 완치자의 혈장을 대량 수집 후 분리과정 등을 통해 혈장 속에 포함된 중화항체(면역글로불린)를 정제·농축해 만든 의약품이다. 30일 GC녹십자에 따르면, 코로나19 혈장 공여 참여의사를 밝힌 ‘참여자’는 26일 기준으로 1223명이다. 이는 한달 전(7월 28일 기준) 1101명에서 11% 늘어난 규모다. 같은기간 실제 혈장을 채취한 공여자는 701명에서 897명으로 27.9% 증가했다. 반면 7월에는 참여자가 한달새 229명에서 1101명으로 380% 급증했다. 또한 공여자도 88명에서 701명으로 696% 폭증했다. 결국 8월과 7월의 한달 증가세를 비교해보면 참여자와 공여자가 대폭 떨어진 셈이다. 이는 7월에 종교단체 신천지(신천지예수교 증거장막성전)가 대규모로 혈장 공여에 참여했기 때문이다. GC녹십자에 따르면, 신천지는 562명의 코로나19 완치지가 혈장 공여의사를 밝혔고 이 가운데 실제 409명이 혈장 채혈을 마쳤다. 혈장 공여는 의사만 있다고 해서 할 수 있는 게 아니다. B·C형 감염 여부와 가장 중요한 코로나 바이러스를 무력화할 수 있는 중화항체가 얼마나 형성돼 있는지를 보는 항체 역가 검사 등에서 요건이 충족돼야 한다. 하지만 신천지의 참여를 일회성 요인으로 간주해 제거해봐도 혈장 확보 속도는 둔화된 것으로 나타난다. 실제 신천지 숫자를 제거한 참여자는 8월 한달 539명에서 661명으로 22.6% 늘어나는 데 그쳤다. 이는 7월 한달 동안 참여자가 229명에서 539명으로 135% 늘어난 것에 비하면 6분의1도 안되는 수준이다. 공여자 역시 8월 한달 동안 292명에서 488명으로 67.1% 증가하는 데 머물렀다. 7월에는 88명에서 292명으로 231.8% 늘었었다. 8월 공여자 증가세도 7월에 비해 3분의1 정도로 축소된 것이다. 최근 정부는 질병관리본부를 통해 신천지에 추가로 코로나19 완치자 혈장공여 협조를 요청했다. 신천지를 향한 정부의 추가 혈장 공여 SOS는 이런 측면이 반영된 것으로 풀이된다. 신천지는 정부 요청에 신도 1100명이 2차 단체 혈장 공여에 나서기로 했다. 문제는 앞으로다. 코로나19 재확산에 따른 사회적 거리두기 강화로 완치자들이 혈장 공여 참여를 더욱 꺼릴 수 있어서다. 김진 GC녹십자 의학본부장은 다만 “외출 자제 등 사회적 거리두기 확대로 혈장 확보 속도가 기대했던 것보단 일정부분 줄어들 가능성은 있다”면서도 “기존보다 혈장체혈 사이트의 절대적인 수가 대폭 확대됨에 따라 접근성이 높아져 완치자의 참여가 증가할 것”이라고 기대했다. GC녹십자는 지난 24일부터 코로나19 완치자 혈장 채혈 사이트를 기존 4곳(고대 안산병원, 대구 경북대병원, 대구 파티마병원, 대구 계명대 동산병원)에서 수도권, 강원도 등 21곳의 ‘헌혈의 집’으로 확대했다. 내달 7일부터는 충청도, 경상도, 강원도 등 24곳에서 혈장 채혈을 할 수 있다.김진 본부장은 “혈장이라는 원료가 필요한 치료제 특성상, 공여자 수는 치료제 생산량에 비례할 수밖에 없다”며 “이번 임상 후에도 추가 후속 연구와 실제 의료 현장에서 쓰일 치료제 생산을 위해서는 완치자분들의 협조가 계속해서 필요하다”고 말했다. GC녹십자는 혈장 치료제를 무상으로 공급하기로 결정한 상태다.