뉴스 검색결과 9,280건
- [숫자로 본 K바이오] 국산 백신 자급률은 얼마
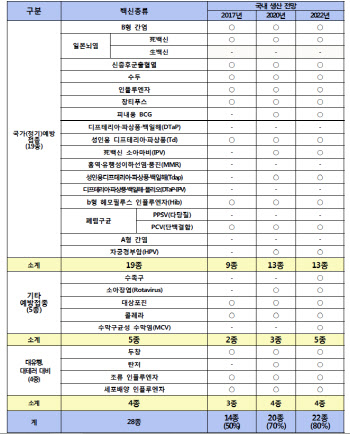
- (자료=식품의약품안전처)[이데일리 노희준 기자] 신종 코로나바이러스 감염증(코로나19)으로 백신 개발에 관심이 쏠리면서 국내 백신 자급률에도 관심이 쏠린다. 결론부터 말하면 국내 백신 자급률은 50%다. 하지만 순수하게 국내에서 바로 만들 수 있는 백신만 고려하면 자급률은 39%로 떨어진다.정부는 감염병 계방 및 관리에 관한 법률에 따라 국가필수예방 접종 백신을 지정·관리하고 있다. 이 지정관리 백신에서 국내에서 생산하는 백신 비율로 자급률을 구한다. 정부는 B형 간염, 일본 뇌염, 수두 등 국가(정기)예방 접종(=국가필수예방접종) 19종과 수족구, 대상포진 등 기타 예방접종 백신 5종 그리고 탄저, 지카, 조류 인플루엔자 등 대유행 및 대테러 대비 4종 등 총 28종의 국가필수 예방 백신을 지정하고 있다. 이 가운데 2017년 현재 국내 생산이 가능한 것은 모두 14종으로 백신 자급률은 50%다. 정부는 2009년 신종플루 사태 때 25%에 불과했던 백신자급률을 8년 만에 2배로 끌어올렸다. 2009년 신종인플루엔자 대유행 이후 백신 중요성이 부각되면서 2010년 이후 백신의 국내 자급 능력 확대 지원 등을 골자로 하는 ‘백신 주권’을 천명했기 때문이다. 하지만 제약업계에 따르면, 백신 자급률 50%에는 일종의 ‘허수’가 포함돼 있다. 국내 생산 백신 14종 중 원료만 생산해 국내에서 백신을 제조하는 게 3종이 포함돼 있다. 해당 백신 3종류는 일본뇌염 사(死)백신과 장티푸스 백신, ‘디프테리아?파상풍?백일해(DTaP)’백신 등이다. 이들 백신은 해외에서 원료를 수입해 국내에서 제조를 해야 하기에 펜데믹(감염병 대유행)상황이나 대터 상황 등 국제질서가 급박하게 돌아갈 경우 국내 생산을 100% 장담하기 어렵다. 실제 코로나19 국면에서 최근 국내 원료의약품 공급의 34%를 담당하는 중국은 다수의 원료공장 생산기지를 폐쇄 조치했고, 10%를 담당하는 인도는 26종의 원료의약품 수출제한 조치를 단행한 바 있다. 문제는 백신 개발이 쉽지 않다는 점이다. 백신은 특정 질병에 대해 생체 내에서 항체(이물질 항원에 대항하는 ‘착한 단백질’)를 유도하게 하는 물질로 개발한 의약품으로 기본적으로 바이오의약품이다. 화학합성의약품처럼 설계도에 따라 ‘뚝딱’ 만들어낼 수 있는 게 아니다. 이 때문에 개발과 생산시설에 대한 투자가 많이 필요하다. 다국적 제약사의 특허 장벽도 높다. 환자를 상대로 하지 않는 백신의 특성상, 임상 대상자를 모집하기 어렵고 주요 타겟인 영·유아를 상대로 하는 임상은 참여에 대한 반감도 넘어야 할 산이다. 무엇보다 이런 난관은 모두 비용으로 작용하는 데다 ‘돈이 안 되는’ 백신도 있어 백신 개발에 뛰어드는 게 현실적으로 쉽지 않다. 정부 역시 백신 자급률 목표치를 계속 낮춰잡는 추세다. 2013년 정부는 2020년 자급률을 80%까지 높이겠다고 했지만 2015년에는 71%, 지난해에는 57%로 다시 202년 자급률 목표치를 낮췄다. 이에 따라 전문가들은 민간의 백신 개발동력을 살리기 위해 정부과 함께 백신 개발에 나설 수 있는 민관 공동 펀드 설립 등의 방안이 필요하다는 지적이 나온다.

- 동국제약, 1분기 코로나여파도 매출·영업익 ‘껑충’ 호실적
- [이데일리 노희준 기자] 동국제약(086450)이 신종 코로나바이러스 감염증(코로나19) 여파에도 불구하고 호실적을 기록했다. 14일 금융감독원에 따르면, 동국제약은 연결재무제표 기준 1분기 영업이익은 193억원으로 전년동기 대비 33.2% 급증했다. 같은기간 매출액은 1306억원으로 전년 동기보다 18.2% 늘었다. 당기순이익도 171억원으로 30.2% 불어났다. 호실적 배경에는 일반의약품 사업부, 전문의약품 사업부, 헬스케어사업부, 해외사업부, 동국생명과학(자회사) 등 전 사업부의 고른 성장이 있다. 일반의약품 부문에서는 모든 브랜드들이 전반적으로 성장한 가운데 먹는 탈모약 판시딜, 여성갱년기 치료제 훼라민Q와, 오라메디 등 구내염 치료제품군이 높은 성장세를 보이며 매출을 견인했다.전문의약품 부문에서는 고지혈증 복합제인 로수탄젯, 피타론에프 등 만성질환 관련 내과영역에서 두드러진 성장세를 보였다. 헬스케어 부문은 ‘센텔리안24 마데카크림 시즌5’의 신제품 출시에 맞춘 대대적인 마케팅과, 더불어 주력유통인 홈쇼핑 채널 추가로 인해 매출이 큰폭으로 증가했다.
- "부모들, 자녀 건강에서 '면역력 증진'에 제일 관심"
- [이데일리 노희준 기자] 우리나라 부모들이 가장 걱정하는 자녀 건강 문제는 ‘면역력’이라는 조사결과가 나왔다. 13일 한국건강기능식품협회는 자녀를 둔 만 20~69세 성인남녀 1947명을 대상으로 설문조사(복수응답)를 실시한 결과 가장 염려되는 자녀 건강 관련 문제는 ‘면역력 증진(27.9%)’이었다고 밝혔다.이후 응답률은 ‘전반적 건강증진(21.6%)’, ‘피로회복(17.4%)’, ‘눈 건강(15.4%)’, ‘스트레스(14.9%)’, ‘성장(14.1%)’, ‘영양 보충(12.8%)’, ‘체지방 감소(10.7%)’, ‘알레르기(10.2%)’ 순이었다.자녀 건강에 관한 주된 고민은 첫째 자녀 연령대에 따라 상이했다. 전 연령대(10대 미만~30대)에 걸쳐 면역력 증진을 높은 우선순위로 두는 점은 동일하나 미성년자는 성장과 영양 보충을, 20대는 눈 건강, 스트레스에 관한 걱정을 차 순위로 뒀다.자녀의 면역력을 높이기 위한 대처 방법으로는 ‘건강기능식품을 섭취하게 한다’는 부모들이 39.4%로 가장 많았다. 이어 ‘식단 및 음식을 조절해준다(10.3%)’, ‘충분한 휴식을 취하게 노력한다(8,4%)’, ‘꾸준히 운동을 시킨다(7.9%)’ 순이었다.한편, 자녀의 건강관리에 지불하는 비용은 한 달 평균 약 6만 7000원 수준인 것으로 조사됐다. 한 달에 5~9만원을 지불한다는 응답이 19.6%로 가장 높았다. 10~14만원이라고 답한 비율은 14.9%였다.건기식협회 관계자는 “최근 전염성 바이러스 등이 유행함에 따라 몸의 기본 방어체계인 면역력에 대한 관심이 높아지고 있다”면서 “연령이 낮은 어린이는 그 체계가 아직 완전하지 못하기 때문에 건강기능식품 등 면역력 강화에 필요한 것들을 챙겨준다면 큰 도움이 될 것”이라고 말했다.